双極性障害(躁うつ病)とは一体どのような病気なのでしょうか。
このブログでは何度も書きますが、統合失調症(精神分裂症)と並んで「2大精神疾患」と言われています。発症率は大うつ病と比べるとかなり低い病気ですが、ポピュラーになりつつあるようです。
この記事は双極性障害に悩んでいる方に向けた応援メッセージです。また、この病気についてまったく関心のなかった方が、何らかのきっかけで興味を持たれることもあるかと思います。「双極性障害とはどのような病気なのか」「どうすればうまく生活できるようになるのか」について、ともに考えるきっかけになれば幸いです。
はじめに
日本では統合失調症の研究が先行してきた歴史があり、双極性障害の研究は遅れていました。しかしいま、日本を含めた世界中で双極性障害の研究はホットです。まだまだ解明されていないところだらけの病気ですが、脳科学の世界は日進月歩です。さまざまなことが日々解明されてきており、それに歩調を合わせ、新薬も開発されています。
この記事では双極性障害の(比較的)新しい研究成果の一部をご紹介し、双極性障害とは何であるのかを脳科学的なアプローチで研究されている方々から得られる情報を共有したいと思います。これによって、自他ともに双極性障害という病気に対する理解を深めることができればと思います。
双極性障害の概要を知りたい方は、以下のページが参考になると思います:
- 双極性障害 – Wikipedia
- 躁うつ病/双極性障害 - 前田クリニック(さらに関連ページへのメニューが画面左側にあります)
双極性障害の原因
原因もメカニズムもまだ解明されていないことが多いのですが、現時点ではおおむね以下のように言われています。
今まで言われてきた原因
- 双極性障害に関連する遺伝子を多数持つ、つまり双極性障害の潜在的リスクのある人が、ストレスなどの外的要因にさらされた時に発生すると考えられ、統合失調症と同様に「ストレス脆弱モデル」という概念で説明されうる。
- メンデルの法則が厳密には当てはまらないこと、一卵性双生児であっても発祥の有無は70%程度の一致であることから、遺伝病とはみなされていない。
- 遺伝要因があっても生活習慣で回避できる可能性はある。社会リズムを保つことや、薬物乱用、ストレスを避けることなどは意義があると考えられる。
現代の研究における原因の予測
- 神経細胞内のカルシウムイオンの制御機能が変調をきたしているとの説があり、現在この説が有力視され、さまざまな研究が世界各国で行われている。
- 双極性障害に効果のあるリチウムやバルブロ酸もカルシウムシグナリングに影響しているために作用している可能性が高いといわれている。
双極性障害とイオンチャネルとの関連性
引用元: 双極性障害とイオンチャネル(イオンチャンネル)との関連性 その1 : 場末P科病院の精神科医のblog
2014年3月9日

イオンチャネル(イオンチャンネル)と双極性障害(BP)との関連性が最近明らかにされてきている。以前、このブログでも述べたように、L型電位依存性カルシウムチャネル(Ca)チャネル(L-type voltage-gated calcium channel subunits)のα-1Cとβ2サブユニットをコードしているCACNA1CとCACNB2の遺伝子が、双極性障害も含めた精神疾患との関連性がゲノムワイド関連解析(GWAS)にて炙り出されたのではあったが(関連ブログ2013年3月17日 5大精神疾患に共通した遺伝子を発見)、このような結果から、双極性障害はカルシウムチャネル疾患ではないかと考えられるようになってきている。
こういった観点からは、双極性障害に対してはカルシムチャンネル拮抗剤が効果を有する可能性があり、既に双極性うつ病へのカルシウムチャネル拮抗剤であるイスラジピン(isradipine)の臨床試験が開始されている。
さらに、治療抵抗性の双極性障害へのプレガバリン(リリカ、N型電位依存性のカルシウムチャネルのα2δ-1サブユニットとα2δ-2にサブユニットに結合してカルシウムチャネルを阻害する。L型にも作用するかもしれない )のオープン試験(補完療法)が既に行われており、効果があることが報告されている。
双極性障害はカルシウムチャネル疾患である可能性があるのであった。
しかし、イオンチャネルはカルシウムだけではなく、ナトリウムチャネルやカリウムチャネルも存在する。双極性障害ではカルシウムチャネルだけが関与しているのであろうか。
いいや、カルシウムだけでなく、カリウムチャネルも関与しており、むしろ、カリウムチャネルの方が大きく関与しているかもしれないのである。
今回は、双極性障害ではカルシウムチャネルだけでなくカリウムチャネルも関連しており、双極性障害はイオンチャネル疾患、特に、カリウムチャネル疾患であるというレビューがあったのでその論文を紹介したい。
精神疾患の病因や病態を規定する分子としてはモノアミンが第1軸であると仮定するならば、近年はグルタミン酸が新たな第2軸として設定されつつあり、そしてさらに、新しい第3軸としてイオンチャネルが設定されるのかもしれない。
川の流れに例えれば、躁うつ病という川の流れの一番下流にはモノアミンが位置し、その上流にはグルタミン酸が位置し、さらに、その上流にイオンチャネルが位置しているといったイメージになるものと思われる(下図)。

薬物治療としては、既に決壊してしまっているモノアミンの段階でのダムにアプローチするよりも(抗精神病薬)、より上流に位置するダムであるグルタミン酸やイオンチャネルにアプローチをした方が適切な対処法である可能性がある。他剤併用になってしまうが、モノアミン・グルタミン酸・イオンチャネルに各々作用をする薬剤を使用し同時にアプローチするのが一番効果的なのかもしれない。
なお、カリウムチャネルは非常に複雑であり、その全容を理解することは容易ではない。カリウムチャネルに関しては下の日本語のサイトに詳しく記載されており、このサイトの解説も是非参照して頂きたい。
(なお、「channel」は、以前は「チャンネル」と日本語では表記していたが、今では「チャネル」という表記が主流になったようであり、今回のブログでは「チャネル」という表記を用いております。)
双極性障害におけるカリウムチャネルについてのレビュー
A review of potassium channels in bipolar disorder
要旨
Abstract
双極性障害(BP)は遺伝性の精神疾患の1つであるが、疾患の原因遺伝子は判明していない。複数の経路にまたがるような複数の遺伝子の変異は、遺伝子型-表現型の関連性に寄与している。最近のゲノムワイド関連研究の結果では、イオンチャネルの構造や調節に関連する遺伝子が関与している証拠があり、BPはイオンチャネル疾患(channelopathies)である可能性が示唆される。このレビューでは、電位依存性カリウムチャネルのBPへの潜在的な役割に焦点を絞り、BPはイオンチャネル疾患であるという仮説を検証した。さらに、遺伝子などの研究から得られた証拠を検討し、BPの基底に存在しうる生物学的な病態を議論した。そして、カリウムイオンチャネル疾患としてのBPの治療について考察した。最後に、中枢神経系のイオンチャネル疾患としてのBPとてんかんとの間における興味深い類似点についても言及した。
遺伝疫学
GENETIC EPIDEMIOLOGY
(詳細は略して要点だけとする)。双極性障害(BP)の双子や養子の研究では、遺伝的な要因が病因であることを示している。BPの家族研究では、一般集団に比べて、BPの発症リスクが発端者の同胞では5~10倍であることを示唆している。双生児の研究では80~90%という高い推定遺伝率である。しかし、関連遺伝因子の同定は未解決のままである。個々の双極性障害の症例へのシークエンス解析では、個人に対する大きな影響を及ぼす稀有な変異の例を明らかにすることはできても、集団レベルでのBPのリスクを説明することはできなかった。BPでは、おそらく、小さな効果を有する多くの遺伝子の変異が集団全体に不均一に存在し、BPのリスクとして集団に影響を及ぼし、その遺伝子の変異体が多くの分子経路に関わることで、様々な程度の経路障害が生じ、それによって個々のケースでのBPの感受性や表現型(症状や重症度)が決まるのであろう。
ゲノムワイド関連解析
GENOME-WIDE ASSOCIATION STUDIES
(これも詳細は略して要点だけとする)。過去20年にもわたりBPの感受性遺伝子を同定するために多くの労力が費やされてきた。人ゲノムプロジェクトの完了、ハイスループットジェノタイピング技術の進歩、遺伝子データベースの充実により、ゲノム全体を公平にスキャンして一般的な多型変異部位を検出するゲノムワイド関連解析(GWAS)に拍車がかった。初期に行われたGWASではBPにのみ有意差を示す遺伝子変異は検出されなかったが、対照や患者のサンプル数を増やすにつれて有意な結果が提示されるようになっていった。
2008年に最初の有意な結果が報告された。Ferreiraらは、4387例のBPと6209例を対照としたGWASの結果からBPの最初の候補遺伝子となるSNPを報告した。rs10994336であり、ANK3(ankyrin G、アンキリンG)遺伝子の中に位置する。2009年、Schulzeらは、以前にプールされたGWASのサンプルを用いて2つ有意なSNPを検出し、ANK3が候補遺伝子であることを見出したが、Ferreiraらが報告したSNPを含んでいた。その後もGWASの結果報告が続いたが、検出されたトップの遺伝子はいづれもANK3であった。ANK3以外の他の候補遺伝子は、BPも含めた5大精神疾患に共通する遺伝子として報告されたSNP(rs4765913)であり、CACNA1C遺伝子の中に位置する。
(ANK3について)

ANK3とCACNA1Cは双極性障害の生物学的な病因メカニズムを示唆していると思われる。ANK3は、電位依存性イオンチャネルの分布を調節するアダプタータンパク質であり、CACNA1Cは、L型電位依存性カルシウムチャネルのα1Cサブユニットである。これは双極性障害がイオンチャネル疾患であるという仮説を支持する所見である。そして、これらのSNPに対する経路分析の結果からも、この仮説は支持されうる。
NIMH GAINとWTCCC GWASのデータを用いて最近行われた経路分析の結果からは、イオンチャネルの構造や調節に関与する遺伝子の関与が示唆された。NIMH GAINのデータによる経路分析にて統計学的に有意な遺伝子セットが16あることが見出されたが、その中の9セットはイオンチャネル/結合/トランスポーターの遺伝子セットである。これらの9セットの中の8セットはWTCCCにサンプルでも有意であると再現された。注目すべき最も重要な遺伝子グループは、電位依存性イオンチャネル活性に関与する遺伝子のセットである。4種の遺伝子だけが遺伝子セットの中で重複するため(注; いろんなセットに出現するような重複が多い遺伝子があればその遺伝子が第一候補となるのであろうが、多くのセットに重複する遺伝子はなかったようだ)、これまでのGWASで検出された少数の遺伝子よりも、双極性障害では、共有する分子機能、すなわち、電位依存性イオンチャネル活性が関連しているものと思われる。
関連する遺伝子セットを同定する別の経路分析としては収束機能ゲノミクス(CFG)アプローチがある。CFGの結果でも、双極性障害におけるイオンチャネル機械の調節不全が関与している証拠が示されたが、カルシウムやカリウムイオンのコントロールだけでなく、細胞の接着に関与する遺伝子セットの関与も示された。
既に述べたこれまでで最大のGWASの一次分析では、カルシウムイオンチャネル遺伝子(CACNA1CとCACNB2)の変異が関与していることが示されたが、さらに、経路分析の結果でも、カルシウムチャネル活性に関与する遺伝子は、複数の精神疾患中で多面的な効果を及ぼしていることが示唆されている。これらの知見は、カルシウムチャネルの機能を変化させる遺伝子変異は、双極性障害だけでなく、他の精神疾患にも共通する基本的なメカニズムに寄与していることを示唆している。
注; カルシウムイオンチャネル遺伝子のみで5大精神疾患が全て説明できる訳ではないだろう。それでは双極性障害も統合失調症も自閉症も全ての精神疾患が同じになってしまう。おそらく、症状や重症度といった疾患の表現型の一部としてカルシウムイオンチャネル遺伝子が関与しているのであろうが、双極性障害を他の精神疾患から区別させうる他の遺伝子の関与が重要なのではなかろうか。その1つがカリウムイオンチャネルなのだと著者らは言いたいようである。
カリウムイオンチャネル遺伝子の知見
GENETIC FINDINGS WITH POTASSIUM ION CHANNELS
CACNA1Cの影響もあり、双極性障害(BP)におけるカルシウムイオンチャネルの役割ばかりが注目されている。しかし、双極性障害はカリウムチャネルも大きく関与している可能性がある。NIMH GAINサンプルの再GWAS分析からは、カリウムイオンチャネルもまたBPの病因に寄与している可能性があることが示されたのである(この点に関しては論文としてはまだ未報告であるが)。すなわち、ANK3遺伝子と相互作用をする遺伝子である。ANK3は神経細胞内の他の膜結合タンパク質と分子的に相互作用するタンパク質をコードしている。そこで我々は、ANK3遺伝子がコードするタンパク質と相互作用をするタンパク質をコードする他の遺伝子がBPの感受性に寄与することができるかどうかを検証した。
(カリウムチャネルの種類について)
我々は、STRING 9.0バイオインフォマティクスデータベースを用い、ANK3と相互作用する物質(タンパク質)を同定した。さらに、ANK3のSNPとそれらのタンパク質がBPに関連するような相互作用を有するかをテストした。最も重要な発見は、ANK3とKCNQ2との間の相互作用であった。ANK3とKCNQ2の相互作用はKCNQ2の2つのSNPが関与していた。すなわち、KCNQ2遺伝子のrs2282150(イントロン中にあるSNP)とrs2297385(アミノ酸の配列を変化させない同義コーディングのSNP)の2つのSNPであり、これらのSNPはANK3遺伝子の16の異なるSNPと相互作用をすることが分かった。さらに、そのANK3遺伝子の16のSNPの全てが、タンパク質ータンパク質間の相互作用を媒介する機能ドメインであるアンキリンリピートの境界に位置していた。WTCCCサンプルからのデータでもANK3とKCNQ2が相互作用をすることが示唆された。さらに、KCNQ3もANK3と相互作用をすることが示唆された。KCNQ2とKCNQ3遺伝子は、ニューロンに存在する電位依存性カリウムイオンチャネルの構成要素であるヘテロ四量体複合体を形成するタンパク質をコードしている遺伝子である。
(双極性障害とKCNQ2との関連性)
(アンキリンリピートについて)
(KCNQ2について)
(KCNQ3について)
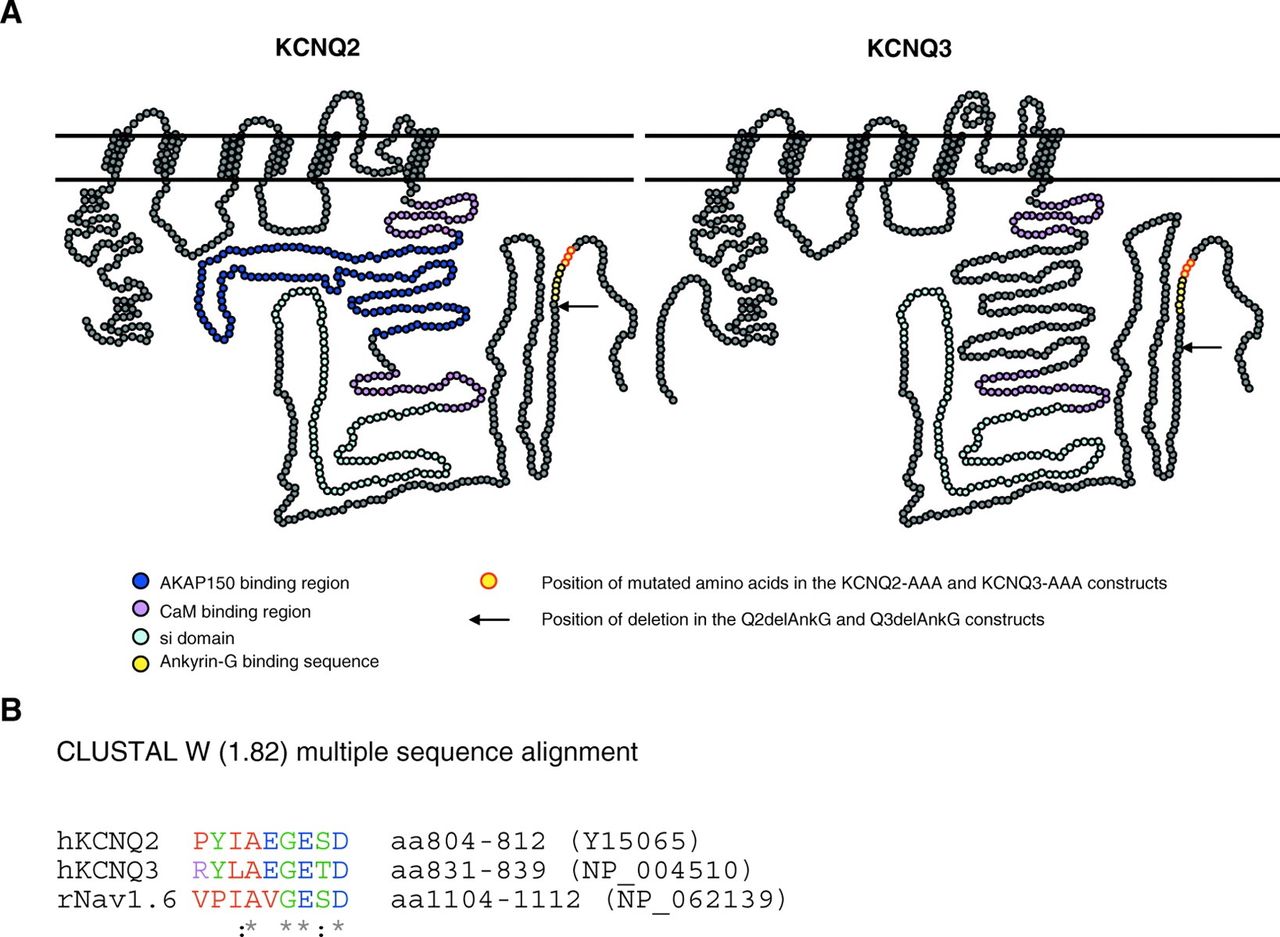
注; 補足しておくと、このレビューの著者らが発表した論文では(上で示したURL)、ANK3はKCNQ2とKCNQ3と相互作用し、軸索起始部(AIS)中のカリウムチャネルの局在化を指図するアダプタータンパク質である。KCNQ2 / 3複合体は、AISにおける神経細胞の静止電位を安定化し、活動電位の反復的な発火を抑制するM電流を生じさせる。これらのチャネルは神経細胞の興奮を「減衰」させる要素として機能しており、神経細胞の機能亢進を防いでいる。と解説されている。すなわち、ANK3の機能が低下すると神経細胞の過剰な興奮(機能亢進)が防止できなくなることを意味する。
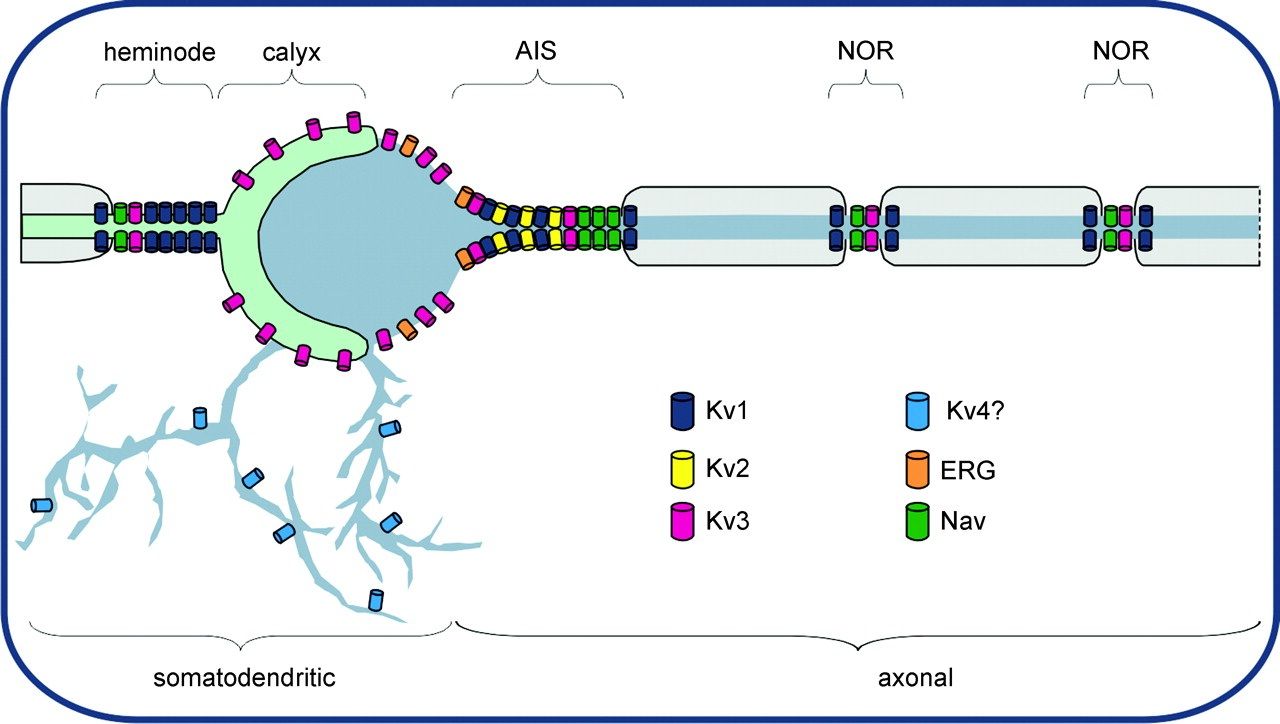
注; なお、ANK3はナトリウムチャネルの調節にも関与しているようである。さらに、KCNQ1は2型糖尿病にも関与しており、双極性障害と2型糖尿病との合併にも関与しているのかもしれない。
興味深いことに、GWAS以前の手法である家系を用いた遺伝子研究においても双極性障害とKCNQ3などのカリウム関連遺伝子との関連性が示唆されている(ゲノムワイド連鎖研究などでの報告。詳細は省略する)。KCNQ2も同様にBPに関与していることが示唆されている。ある研究の結果では、KCNQ2のSNPがカリウムチャネル活性を抑制するという神経機能に関する結果が示された。その論文の著者らは、カリウムチャネル活性が抑制されると、躁と軽躁状態の特徴であるニューロンの過剰な興奮をもたらすかもしれないという仮説を提示した。
双極性障害の候補遺伝子としてのカリウムチャネルに関連する他の遺伝子もこれまでの分析研究から示唆されている。KCNN3遺伝子である。KCNN3は、電位非依存性のカルシウムにより活性化されるカリウムチャネル(voltage-independent calcium-activated potassium channel)であり、このKチャネルは、活動電位のイベント後に生じるシナプスの過分極の遅いコンポーネントを介してニューロンの興奮性を調節していると考えられている。
(SK3チャネル=KCNN3について)
KCNN3遺伝子のエクソン1に高頻度で出現するCAGリピートの多型配列はBPに関与していることが報告されている。しかし、これらの研究サンプルをプールしたデータをメタアナリシスした結果ではそのような証拠は提示されなかった。しかし、メタアナリシスを行った研究者らは、その多型は症状の重症度といった双極性障害の部分的な表現型と関連している可能性は否定できないとした。確かに、最近行われた統合失調症のサンプルの分析では、長いCAGリピートと認知タスク(識別、選択、遂行)への良いパフォーマンスとの関連性が見出されている。なお、CAGリピートの繰り返しが多くなることはSK3チャネルの機能の低下を意味する。
双極性障害におけるカリウムイオンチャネルとの関連性のさらなる証拠が遺伝子発現の研究からも提示されている。スタンレー財団死後脳コレクションの双極性障害の線条体や側坐核(STR-NAC)や小脳のサンプルにおける72種のイオンチャネルサブユニットの発現状況が解析された。気分安定化剤はイオンチャネル活性を直接阻害するという能力があるため、気分安定化剤の影響がないサンプルを調査した。その結果、KCNQ2、KCNQ3、KCNA4遺伝子のアップレギュレーションだけでなく、電位依存性I型ナトリウムチャネル(voltage-gated type I sodium channel)遺伝子のα-サブユニットとβ-サブユニットをコードする遺伝子であるSCN1A遺伝子とSCN1B遺伝子のアップレギュレーションが見出された(小脳半球での所見)。線条体と側坐核では、KCNS3、KCNA1のダウンレギュレーションと、KCNN3のアップレギュレーションが見い出された。興味深いことに、もっとも著明な変化を示した遺伝子は小脳におけるKCNQ3(P = 0.012)とSCN1B(P= 0.004)であった。
一方、抗精神病薬(クロザピン、ハロペリドール、オランザピン)を投与されたマウスの全脳のmRNA発現を調べた研究がある。その結果、抗精神病薬によってKv1カリウム電位依存性チャネル(Kv1 potassium voltage-gated channel)のサブユニットをコードする2つの遺伝子、すなわち、シェーカー(shaker)関連サブファミリーのKCNA1とKCNAB1と、Kvチャネルと相互作用するタンパク質をコードするKCHIP遺伝子の発現が変化することが示された。これらの結果から、抗精神病薬の作用メカニズムは、ニューロンの電位依存性イオンチャネル、特に、カリウムチャネルとナトリウムチャネルを調節することであり、それによってニューロンの電気的活動性や神経伝達が変化することであると論文の著者らは結論付けた。
さらに、ラットの脳における電位依存性カリウムチャネルのサブユニット遺伝子の発現レベルに対する電気けいれん療法(ECT)の効果を調べた研究がある。ECTは、電流を短時間通電させてけいれん発作を誘導するである。しかし、時間の経過とともに、ECTは抗けいれん特性を有するようになる(電気ショックでのけいれん発作が生じにくくなる)。躁病へのECT使用の事例もあるが、ECTの主な適応疾患は大うつ病である。初期の研究では、カリウムチャネル遺伝子の発現レベルは慢性や急性のECTによって変化するが、その変化はカリウムチャネルのタイプ、脳の領域、ECTのタイミングに特異的であることが見出された。その後の研究では、慢性ECTにてカリウムチャネルの発現は有意に増加するが、カリウムチャネルのサブタイプや脳の領域に特異的であることが再び見出された。論文の著者らは、カリウムチャネル遺伝子は膜電位の調節に不可欠であるため、mRNAの発現の増加は、ECTの発作閾値上昇作用に関連している可能性があると結論付けた(=電位依存性カリウムチャネルであるKv7.2とKv11.1の遺伝子発現を増加させることがECTの臨床効果かもしれないと結論付けた)。
注; なお、他の調査でも双極性障害とカリウムチャネルとの関連性が示されている。2013年にGWASのサンプルを用いて、対立遺伝子に特異的なメチル化された遺伝子による経路分析の結果が報告されたが、それによれば、カルシウム、カリウム、ナトリウムという3種のイオンチャネルに関連した遺伝子セットの濃縮が認められた。その中の遺伝子にはこのレビューでも触れられているカリウムチャネルに関する遺伝子が多く含まれていた(KCNB2、KCNK3、KCNQ3などが特に有意度が高かった)。
注; さらに、NIMHが行った研究の中に、他のカリウムイオンチャネルであるKCNH2が神経細胞の発火に関与しており、KCNH2のアイソフォームの1つであるアイソフォーム3.1の過剰な発現が統合失調症の症状、すなわち、異常に増加した神経細胞の興奮性、回路暴走、非効率的な情報処理といった病態に関連しているだろうという研究結果がある。こういったメカニズムは双極性障害でも関与している可能性がある。
この機会に、論文では触れられていなかったことで重要だと思われることを補足しておく。
昨年度に出されたある論文では、カリウムチャネルの機能を発揮するには脂質の二重層におけるループ構造が必要であることが示されている。言い換えれば、脂質の二重層が障害されれば、カリウムチャネルの機能が発揮されなくなってしまうのである。
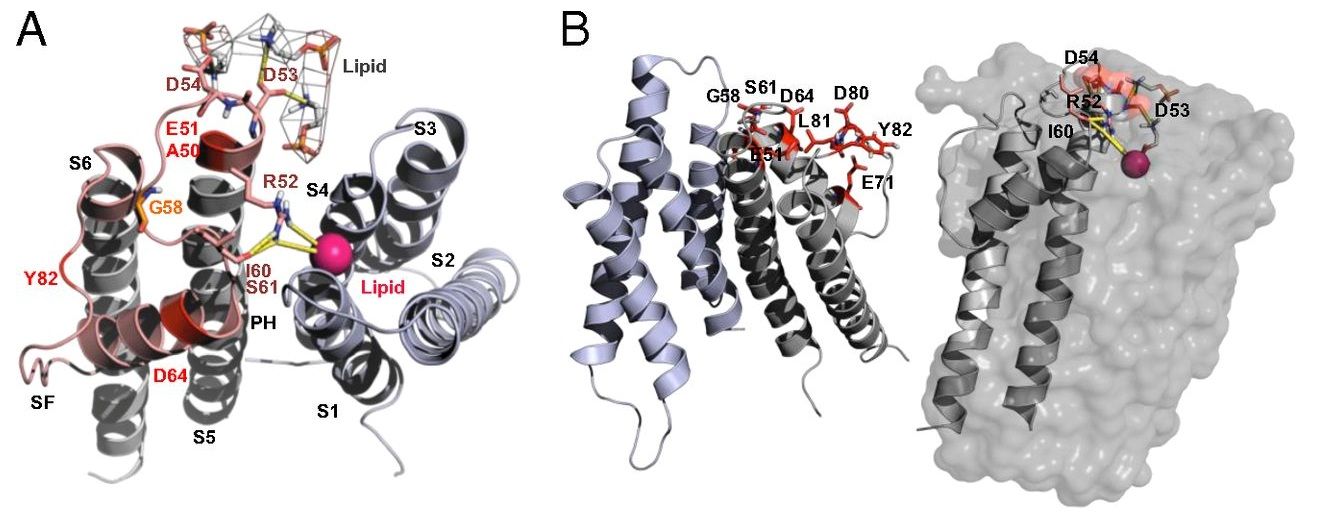
脂質の二重層で重要な役割をしているのがω3脂肪酸(DHA)である。双極性障害ではω3脂肪酸を補給しておくことがカリウムイオンチャネルの機能を保証する上で重要になろう。
一方、髄鞘(ミエリン)という神経の軸索を覆っている絶縁体が傷害されれば、カリウムイオンチャネルの機能も障害されてしまう可能性が高い。カリウムイオンチャネルは軸索を覆うミエリンを形成しているシュワン細胞に多く存在する。すなわち、ミエリンの傷害はカリウムイオンチャネルの障害を惹起することになる。従って、ミエリンが傷害されれば神経の興奮性伝達が過剰になってしまう可能性がある。以前のこのブログで紹介した脱髄という現象が双極性障害の原因であるという仮説もある程である(関連ブログ2013年6月9日 双極性障害はMSなどと同じような脱髄性疾患である。ただしMSとは異なり広範囲ではなく限局性のミクロな脱髄に留まっているのではあろう)。
ミエリンの障害は炎症や酸化ストレスなどが原因となる。軸索のミエリンが障害されれば、カリウムイオンチャネルも障害され、神経の過剰な興奮が抑制されなくなることであろう。さらに、ミエリンという絶縁体が傷害されれば、軸索のところどころが裸電線となり、電流がショートしてしまい、神経細胞が興奮していなくてもミエリンが傷害された部位では勝手に活動電位が生じ、神経伝達過剰という現象が生じてしまう可能性もある。
このような観点からは双極性障害においては、中枢神経系における炎症や酸化ストレスを抑えることが重要となる。ω3脂肪酸を補給すると伴に、プロバイオティクスにて腸内細菌叢を整えておくことや、抗酸化作用がある物質(野菜など)を補給しておくことは意味があろう。少なくとも、症状の重症化を抑え、再発を防止する観点からは大きな意味があるのではと私は考えている。
現在の日本の医療では、ω3脂肪酸やプロバイオティクスや抗酸化物質は提供されない。自分自身で自ら補給するしかないのである。そのことを忘れずに、日常の生活の中で自分自身での補給に努めることが重要であろう。
治療の標的としてのイオンチャネル
ION CHANNELS AS THERAPEUTIC TARGETS
イオンチャネルの生理的プロセスは多様性や普遍性を有しており、薬理学的に魅力的な標的となろう。既知の薬剤の中では、約13.4%がイオンチャネルへの作用を持っており治療薬と成り得る。このようにイオンチャネルは、Gタンパク質と共役する受容体の背後に存在する第2の薬理学的な標的としてランク付けされることであろう。
イオンチャネルを調節する薬剤が双極性障害の治療となり得ることを示唆する証拠が増えてきている。単純な1価陽イオンであるリチウムはBPの第一選択治療である。その作用機序は、未だ明らかにはなっていないが、イオンチャネルの機能に影響を与えるという証拠がある。最近の研究では、マウスの脳組織をリチウムで処理したところ、BPでの治療濃度では、リチウムはナトリウムチャネルを介して細胞内に入り、膜の興奮性を直接変更する外向きの膜電流を抑制することが同定された。論文の著者らは、神経細胞の興奮性を調節しているイオンチャネルは、双極性障害の治療としての標的になり得る可能性があると結論付けた。

リチウムはまた、細胞内のグリコーゲン合成酵素キナーゼ3β(GSK3β)を直接的に強力に阻害する。GSK3βは多くの機能を有しているが、その1つとして電位依存性カリウムチャネルのKCNQ2をリン酸化する作用がある。このKCNQ2のリン酸化はKCNQ2チャネルの活性を低下させ、その結果、M-チャネル電流が減少することが示された。この所見からは、リチウムの治療効果は、KCNQ2のリン酸化に由来すると推測することができる。
バルプロ酸、ラモトリジン、カルバマゼピンなどの抗てんかん薬(AED)は双極性障害への治療薬として長い歴史を持つが、リチウムと同様に、イオンチャネルの機能を介して、神経伝達や活動電位の発火の調節に影響を及ぼしている可能性がある。双極性障害に対して効果を発揮する抗てんかん薬は、薬剤の有効性に様々な形で寄与しうる多種の分子を標的として作用している可能性があるが、BPに効果を発揮する全ての抗てんかん薬は、細胞内のナトリウムイオンの流れや蓄積を減少する作用(=神経細胞内のイオン濃度を変更する作用)があることに注目すべきである。
電位依存性カリウムチャネル、特に、KV7チャネルは、双極性障害の治療薬としての魅力的で新しい標的となろう。KV7チャネルを介することで神経機能への選択的な介入が可能になる。例えば、ezogabine(EZG、一般名retigabine)は最近、部分てんかんの治療薬としてFDAによって承認されたが、EZGはカリウムチャネルエンハンサーである。EZGは、KCNQ2/KCNQ3のヘテロ四量体イオンチャネル複合体を活性化するが、それによってM-電流を促進し活動電位の発火を安定化させることが示されている。この作用を有する薬剤は抗けいれん特性を発揮する可能性が高い。
EZGや他のKV7チャネルエンハンサーの気分安定作用が研究されている。ある研究では、躁病のモデルマウスを使用して、EZG(非選択的なチャネル開孔剤)、ICA-27243(選択的なKv7.4/3チャネル開孔剤)、BMS-204352(Kv7.4/Kv7.5とKv7.7/3の選択的なヘテロ四量体チャネル開孔剤)は、抗躁作用の指標である多動マウスの運動性を減少させた。
さらに、別の研究では、EZGは、d -アンフェタミン+クロルジアゼポキシド(AMPH + CDP)マウスの脳グルコース代謝活性を低下させたが、一方で、GSK3βのセリン9のリン酸化のレベルを増加させた。GSK3βのセリン9のリン酸化のレベルの増加はリチウムやバルプロ酸と全く同じような抗躁病薬に共通する分子メカニズムであり、EZGは新規の抗躁病治療になり得ることを示唆していると結論付けられた。
オープンラベルパイロット研究としては小さいサンプル数(N=10)ではあるが治療抵抗性のBP1型の躁病相におけるEzogabineの効果が評価された。限定されたサンプル数、簡易な試験デザイン、疾患の重症度にも係らず、躁症状スコアの改善が4人の患者で観察された。Ezogabineは、うつ病相を惹起することはなく忍容性は良好であった。さらなる研究が必要である。
(Ezogabineは日本でもいずれ発売されることであろう。治療抵抗性の双極性障害への期待が高まる。)
注; 他の抗てんかん薬であるCarisbamate(開発中)も双極性障害に効果を有する可能性が既に報告されている。
注; さらに、EZG以外でもカリウムチャネルを開孔させるメカニズムを意識した薬剤の開発が進められている。1例として、KV7カリウムチャネルオープナーとしてのピペリジニルピリミジンアミド(Piperidinyl Pyrimidine Amides)がある。次世代の向精神薬はイオンチャネルに作用する薬剤が主流になるのかもしれない。
神経のチャネル疾患
NEURONAL CHANNELOPATHIES
これまでの分子遺伝学的研究からは、双極性障害の原因(の一部)はイオンチャネル異常(channelopath)である可能性がある。「channelopathy」という用語はイオンチャネルの機能障害を意味する新しい医学用語である。イオンチャネルは、複雑であり、個別に孔を形成し、アクセサリーサブユニットから構成される膜貫通性の糖タンパク質から成る。イオンチャネルの孔は、イオンに対しては不透過性で疎水性の細胞膜を貫通し、帯電したイオンの選択的で受動的な細胞内への輸送を可能にしている。イオン自身の実際の動きはそれ程重要でないが、イオンの動きによって生じた貫通電流という電気的な興奮の導出が生理学的に大きな役割を有している。
これらのイオンチャネルに由来する電流によって神経細胞の活動電位などの電気的信号が調節されている。ナトリウムやカリウムイオンの膜の透過性に対する変化によって生じる一過性の活動電位は、神経伝達物質という符号に変換されて、ニューロン間の情報伝達を促進する電気的なイベントである。ナトリウム(Na +)チャネルは初期の脱分極(または立ち上がり)の活動電位の中心的な存在として関わっており、カリウム(K +)チャネルは、静止電位に戻すための再分極相の中心的な存在として関わっている。
イオンチャネル遺伝子は、ゲノム全体の1~2%に相当し、少数派でありであり、かつ、他の遺伝子よりも組織に最も特異的に発現している。さらに、イオンチャネルは機能的な特異性も高いく非常に多様である。その多様性は、イオンチャネルとしての機能の1単位を形成するアセンブルファミリーメンバー同士のヘテロマーの様々な組み合わせパターンによって増幅される。さらに、選択的なスプライシングを通じて、サブユニットの構成が変化することよって、イオンチャネルの機能が変化する。イオンチャネルは、様々な組織における広範囲にわたる生理学的なプロセスの役割を有しているが、その一方では、イオンチャネル遺伝子の変異は、しばしば特定の組織のみに特異的な疾患を生じることになる。
人間のチャネル病の中でもカリウムチャネルは非常に特徴的である。カリウムイオンチャネルの構造や機能は様々であり、他のイオンチャネルのグループよりも種類が多く、そのため生理機能の変質も多様である。特に、KCNQ遺伝子ファミリー(KCNQ1~5 、Kv7.1~5とも呼ぶ)の変異は人のチャネル病としては特徴的である。ヒトの疾患との関連が証明されている10種のカリウムチャネル遺伝子のうち、4種はKCNQ遺伝子のサブファミリーに属する。さらに、5種のKCNQ遺伝子ファミリーメンバー遺伝子中の4種が4つの異なる遺伝病と関連している。多様性、普遍性、機能的な重要性において、KCNQ遺伝子ファミリーは、既に同定されている多くの疾患の病因において重要な役割を果たしている可能性が高い。
上述したように、2種のKCNQ遺伝子ファミリーのメンバー、KCNQ2とKCNQ3は双極性障害の病因に特に関連しうるであろう。KCNQ2とKCNQ3は、双方ともに、脳内で発現しており、ヘテロマーを形成し、ホモメリック電位依存性カリウムチャネルを構成する。ANK3はニューロンのランビエ絞輪の軸索起始部(AIS)にKCNQ2/KCNQ3チャネルが局在できるような方向性を示す手助けをしている。実際、ANK3ノックアウトマウスではKCNQ2/KCNQ3チャネルの局在性は無くなってしまう。
KCNQ2やKCNQ3のAISにおける重要な役割は、Mタイプのチャネルを形成することであり、Mタイプのチャネルはサブスレッショルド(閾値以下)のM電流を媒介する。これらのM電流は、ニューロンの静止電位を安定させ、活動電位の反復発火を抑制し、ニューロンの活動亢進を防止している。このようなKCNQ2/KCNQ3活性の障害は、ニューロンの活動亢進が生じていくため双極性障害の病因となろう。この仮説を支持するような動物モデルでの研究がある。この動物モデルでは、KCNQ2遺伝子の機能を阻害するような変異によりM電流が抑制され、その結果、神経細胞の過剰興奮、海馬の形態学的変化、認知機能の著しい低下、多動等の行動の変化を示す。興味深いことに、良性家族性けいれん(常染色体優性遺伝)の関連遺伝子としてKCNQ2が同定されている。
双極性障害とてんかん
BIPOLAR DISORDER AND EPILEPSY
双極性障害と「てんかん」とは多くが重複する特徴を有し、この2つの疾患は、中枢神経系のイオンチャネル疾患を代表するような表現型だと思われている。てんかんは、繰返えされる突然の発作が起きる脳の障害であり、興奮性の電気信号の異常が原因である。てんかんは、チャネル疾患として証明されているいくつかのサブタイプがあり、イオンチャネルの障害から生じ得る他の中枢神経系(CNS)の疾患を説明するための疾患モデルとして適用することができる。具体的には、イオンチャネルが関与しているという共通の神経生物学的な視点からは、双極性障害とてんかんの間には多くの類似点が存在する。
双極性障害とてんかんとの間の最も強い類似点の1つとしては、疾患としての経過であり、その経過の形はリズム機能が散発的に障害されるという経過をたどることが多い。双方の疾患は、多くの場合は慢性化に移行し、時には治療抵抗性となる。こういった経過は「キンドリング(kindling)」として知られており、閾値以下の刺激がエピソードが自然に誘発されるようになるまで繰り返されることで生じていくが(発作が繰り返されるごとに発作の域値が下がって発作が起きやすくなっていく、すなわち発火しやすくなっていく)、こういった進行の仕方はてんかんや双極性障害の双方に認められる特徴である。
(キンドリングについて)

このキンドリング現象は、ストレスに対して感受性が髙くなるような持続的な生理的変化を脳内に残すと考えられている。てんかんと双極性障害の双方の治療に使用されるような抗てんかん薬、すなわち、カルバマゼピン、バルプロ酸、ラモトリギンは抗キンドリング特性と持つと言われている。
(注; 抗キンドリング作用は、ジプレキサやエビリファイでは報告されておらず、ましてや、ジプレキサやエビリファイは抗てんかん薬ではない。下流のドーパミンを抑えているだけに過ぎない。ジプレキサやエビリファイは躁病相の急性期では効果は確かにあろうが、維持療法として使用し続けることに関しては疑問である。急性期が過ぎた後の躁病相の維持療法においては、バルプロ酸やラモトリギンなどの抗てんかん薬を使用していた方がキンドリングという現象を防ぐことができ、再発防止や再発時の重症化防止には役に立つのかもしれない)。
気分障害は、しばしばてんかんと合併する。以前の調査では、双極性障害の患者がてんかんとも診断されることは殆どないという結果であった。しかし、米国における大規模な調査では、てんかん患者の12.2%に双極性障害の症状を有する証拠が見出されたが、これらのほぼ半数(6%)が医師から双極性障害という診断を受けていた。双極性障害が合併する比率は、てんかん患者における他の併存疾患よりも高かった。
てんかん患者に双極性障害が高率に併存するということは、てんかん患者は強力な気分安定化剤(抗てんかん薬)で治療されていることを考えると不可解である。さらに、発作間欠期不快気分障害(IDD、interictal dysphoric disorder)という気分感情症候群が、てんかん患者の0.1~4.3%で生じることが知られている。(注; IDDに関しては、まだ議論の余地があるため、概念としては確立している訳ではないようだ)。
てんかん患者143名の調査では、11.8%の患者がDSM-IVによって双極性障害の診断を受けたが、IDD、てんかん発作、抗てんかん薬の治療とは無関係な「純粋な」双極性障害と考えらたケースはわずか1.4%であった。IDDの症状は、てんかんの神経症状とは生理学的には異なる病態だと考えられているが、これらの双極性障害の様な症状の病因が双極性障害自体とどのように関連しているかは不明なままである。いずれにしても、てんかんと双極性障害の症状が類似している点からは、イオンチャネル疾患という共通の病態生理メカニズムを示していると推測するのが妥当であろう。
てんかんと双極性障害はイオンチャネル疾患としてオーバーラップしていることを支持するような、てんかんと精神病の家族を調査した疫学所見がある。てんかん患者は、広義の精神病のリスクが通常よりも5.5倍に増加し、統合失調症のリスクは8.5倍に増加し、双極性障害のリスクは6.3倍に増加することが見出された。また、親がてんかんを有する場合は、親がてんかんの病歴を有さないケースと比較して、子供が精神病を有するのリスクは2倍に増加し、逆に、親が精神病の病歴を有する場合は、子供がてんかんを有するリスクが2.7倍に増加していた。
双極性障害とてんかんとの間には最終的に並立している1つの事象があるが、それは治療薬が重複していることである。注目すべきことに、カルバマゼピン、ラモトリギン、バルプロ酸などの多くの抗てんかん薬は、双極性障害にも有効である。実際に、バルプロ酸は急性躁病だけでなく、躁病予防の第一選択薬だと考えられている。リチウムやバルプロ酸という1次選択剤の単剤治療で反応しない場合は、カルバマゼピンやラモトリギンが気分安定剤の2次選択剤の中心となる。ラモトリギンは、双極性うつ病に対して特に有効であることが示されている。
注; ラモトリギン(LTG)を双極性うつ病や双極性障害の維持療法の第一選択剤にすべきかは、まだ議論されている。LTGが既にガイドラインでは推奨グレード「A」になっている国もあるが、異論もある。LTGは、電位感受性ナトリウムチャネルを遮断することにより、ナトリウム依存性のグルタミン酸の放出を阻害することで抗てんかん作用を発揮する。さらに、LTGは、N型カルシウムチャネルを遮断し、カリウムの外向き電流を介して神経の興奮性を減衰させることで効果を発揮する。うつ病の動物モデルでは、強制水泳実験における無動の時間をLTGは短縮した(=ラモトリギンには抗うつ効果あり)。その作用はナトリウムチャネル開孔剤によって逆転したため、ナトリウムチャネルのブロッキングがLTGの抗うつ機構であると推察されているが、まだ、詳しく解明されている訳ではない。
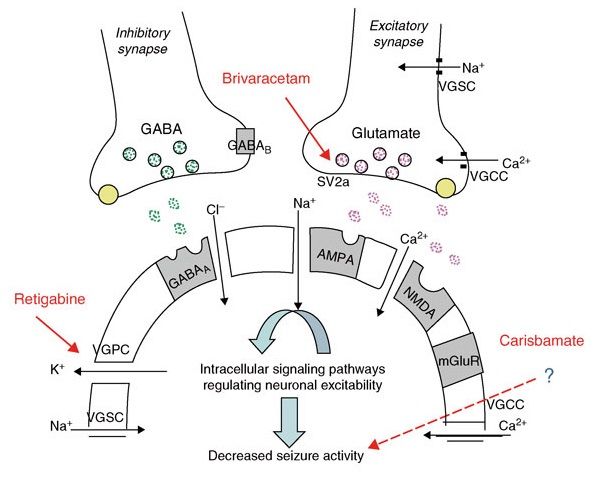
これらの抗てんかん剤の作用機序は、双極性障害に対する場合とてんかんに対する場合では必ずしも同じではないかもしれないが、治療薬がオーバーラップしている点からは、双極性障害とてんかんのと間には、少なくともいくつかの共通した病態生理(=イオンチャネル疾患)が存在していることが推測される(既知の抗てんかん薬の作用機序。下図)。

考察
DISCUSSION
過去数十年にわたり、多くの労力と資源が双極性障害の遺伝的寄与を研究に費やされてきた。決定的な障害を引き起こす遺伝子はまだ何も示されてはいないが、多くの発見によって、双極性障害の複雑な遺伝子的構造のごく一部が解明された。双極性障害では、イオンチャネルの構造と制御に関連する種々の遺伝子が関与しているという証拠は、以前の連鎖研究などでも示されていた。最新のGWASによる遺伝子のSNPや経路分析でも、イオンチャネルの機能が関連していることが支持されている。
双極性障害の疾患としての経過、特にそのエピソードの性質は、イオンチャネル疾患としてのパラダイムに合致する。疫学的な証拠だけでなく、生物学的にも双極性障害はイオンチャネル疾患であるという妥当性があり、神経活動に大きな影響を及ぼすイオンチャネル遺伝子は、双極性障害の病因として注目すべきである。現在、双極性障害のイオンチャネルへの焦点は、カルシウムイオンチャネルに集まっているが、カリウムイオンチャネルも病因に寄与しており、さらなる研究に値するものであるということを確認してほしい。
双極性障害の感受性に寄与する遺伝子の同定をすることが重要である。双極性障害の遺伝子メカニズムを解明することは、副作用が少なく、より効果的な治療法をとなる薬剤開発を促進し、新たらしい治療の標的を明らかにしてくれる。さらに、遺伝子スクリーニングを介した双極性障害の診断方法を開発することができるようになる。疾患遺伝子の同定は、疾患の原因となる遺伝子の異質性を有するような疾患の場合には、特に臨床的に大きな意味がある。なぜならば、治療の過程は疾患の病因(疾患遺伝子)に依存するからである。
(論文終わり)
なお、今回は双極性障害におけるカリウムイオンチャネルに限定した内容だったのだが、多くの精神疾患が多くのイオンチャネルに関連することが示されていることに注意してほしい。
下のレビューは、精神疾患とのイオンチャネルとの関連性についてのレビューであり、このレビューも参考にして頂ければ幸いである(膨大な論文であり、読むのが大変ではあるが一読の価値はある)。
簡単に要約すれば、カルシウムイオンに関連する遺伝子としては、CACNA1C、 CACNG2,4,5、CACNA2D4などの遺伝子が、双極性障害、統合失調症、大うつ病、自閉症スペクトラム障害、ADHD、ティモシー症候群などに関与していることが示されている。
ナトリウムイオンに関連する遺伝子では、SCN1A、SCN2A、SCN3Aなどの遺伝子が、自閉症スペクトラム障害、てんかん、Dravet症候群などに関与することが示されている。
カリウムイオンとしては、既に触れられたKCNQファミリーやKCNHファミリー、KCNJファミリーなどが、双極性障害、統合失調症、自閉症スペクトラム障害、自己免疫神経精神障害、学習障害、てんかんなどに関与していることが示されている。
個々の遺伝子がコードするイオンチャネルの具体的な構成要素や疾患に関わるメカニズムについては論文で詳しく解説されているので論文を参照してほしい。
なお、下の表に簡潔にまとめられているので参照して頂きたい。
なかなか病状が安定しない精神疾患のケースでは、イオンチャネルに作用する薬剤をトライするのも有効な対処法の1つとなろう。特に、カルシウムチャネルにマイルドに作用するプレガバリン(リリカ)は多くの精神疾患への補完的な薬剤として応用できる可能性がある。血圧に注意しつつカルシウム拮抗剤を試す方法もあろう。さらに、日本でも治験が始まるであろうカリウムチャネルに作用するretigabineなどのKV7チャネルを開孔する薬剤は、ドーパミンの神経伝達の過剰をも抑制できるようであり、統合失調症にも効果が期待できるものと思われる。
エビリファイ
2013年度のアメリカでの薬剤の売上No. 1は、エビリファイ(Abilify)でした。おsの売上額は、なんと64億ドルです。日本円にすると1ドル100円換算で、6400億円です。ちなみにエビリファイは、大塚製薬が開発した薬です。
エビリファイは大きく分けて3種類の用途があります。
- 気持ちをおだやかにします。強い不安感、緊張感、興奮状態、うつ状態など、さまざまな精神症状に応用されています。
- 統合失調症による脳の情報伝達系の混乱を改善します。
- さらに、双極性障害(躁うつ病)の改善にも効果があります。気分の高揚をしずめ、躁症状を落ち着かせるのに役立ちます。また、うつ症状の改善も認められています。
アメリカ人もたいへんですね。
エビリファイの特徴
- 新しいタイプの非定型抗精神病薬です(第3世代抗精神病薬)。ドパミン系神経を正常状態に安定化させる調整薬で、ドパミン・システムスタビライザー(DSS:Dopamine System Stabilizer)と呼ばれています。その特徴的な作用にもとづき、従来からの統合失調症の効能にくわえ、双極性障害とうつ病に対する効能を新たに取得しています。副作用も少ないことから、旧来の定型抗精神病薬に代わり たいへんよく処方されるようになりました。
- 統合失調症の陽性症状と陰性症状の両方に効果があります。情動安定化作用や再発予防効果が期待でき、また過鎮静を生じにくいので、長期の維持療法に適します。一方、速効的な鎮静作用は弱いので、強い不安や興奮、混乱状態などをともなう急性増悪例には不向きです。
- 従来の抗精神病薬に比べ、錐体外路症状(ふるえ、こわばり)や高プロラクチン血症(生理不順、乳汁分泌)、眠気、過鎮静、体重増加などの副作用が比較的少ないです。一方で、錐体外路症状のうちアカシジア(じっとできない、そわそわ感)の頻度が高く、また高血糖を生じるなど特異な副作用もみられます。

エビリファイの薬理
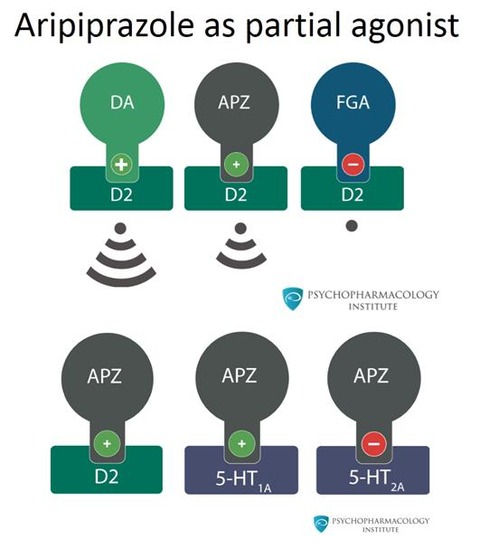
ドパミン・システムスタビライザー(DSS:Dopamine System Stabilizer)といい、おもに脳内ドパミン系神経に調整的に働きます。薬理学的にはドパミンD2・D3受容体部分作動薬またはパーシャルアゴニストと呼ばれ、アンタゴニストとしてドパミン阻害作用を示す一方で、アゴニストとしての内活性作用をあわせ持ちます。そして、脳内でドパミンが過剰に放出されているときには阻害薬として抑制的に働き、逆にドパミンが不足しているときにはきドパミン作動薬として活性化する方向で作用するのです。さらに、セロトニンに対しても、同様に調整的に作用することが示されています(セロトニン5-HT1A受容体パーシャルアゴニスト、セロトニン5-HT2A受容体アンタゴニスト)。
脳内のドパミン作動性ニューロンが形成する中脳辺縁系および中脳皮質系に作用し、ドパミン刺激を調節するドパミン受容体により、ドパミンのパーシャルアゴニスト(βブロッカー、オピオイド、ベンゾジアゼピン系睡眠薬、エストロゲンのように生体内の受容体分子に働いて神経伝達物質やホルモンなどと同様の機能を示す、つまり受容体を活性化する作動薬のうち、活性化度が生体分子に比べて非常に低いもの。受容体にプラスに働きながらも、本来のリガンドの結合を阻害してしまうため、結果として抑制の方向に働いてしまうことがある。副作用が出現しにくかったり、依存性が低かったりする)としての作用を有します。このため、ドパミンシステムスタビライザー(DSS)とも呼ばれます。
ドパミンが不足している前頭前皮質では、これを増量させて感情表出能力や無為・自閉などの陰性症状を改善し、またドパミンが過剰に作用している中脳辺縁系ではこれを減少させて厳格、妄想などの陽性症状を改善します。
適度なドパミン活性があるために側座核に作用することで快楽消失などを伴わず、統合失調症患者の物質濫用を防ぐことができます。
なぜエビリファイが売れるのか
適応する精神疾患が多いのが特徴です。つまり、とりあえずエビリファイを出しておけばOKみたいなところがあるようです。アメリカではエビリファイはさまざまな適応症を取得しています。統合失調症、双極性障害(躁、うつ、どちらの病巣にも対応)、発達障害(自閉症を含む)および関連精神症状(癲癇発作など)、うつ病へのSSRIの補完など、さまざまな精神疾患に処方されています。
エビリファイでよいのか?
日本においてもエビリファイ大好きな精神科医が増えているそうです。このような使用方法は診断を疎かにしてしまい、診断が未確定のままで飲み続けることになりかねないというリスクがあります。心理療法の方が好ましいようなケースでは、薬物療法を中心にすべきではありません。
精神疾患にはドーパミン機能失調(機能亢進、機能低下、ドーパミンの放出/退社/クリアランスのバランス異常など)という共通のメカニズムが絡んでいる可能性が高いのですが、ドーパミンだけでは各疾患の本質は説明できません。
エビリファイの使い方
エビリファイはドーパミン受容体に対し、アゴニスト(受容体を活性化する作動薬)としてもアンタゴニスト(拮抗薬、遮断薬、ブロッカーとも呼ばれ、アゴニストの作用を阻害する薬)としても作用する、不思議な薬です。一般に低用量ではアゴニストとして、高用量ではアンタゴニストとして作用すると言われていますが、個々のケースで実際に何mgからと言われるとよく分かりません。もしかしたら病態に応じてアゴニストとして作用すべき時はアゴニストとして、アンタゴニストとして作用すべき時はアンタゴニストとして作用する便利な薬なのかもしれません。それを証明するような論文はまだありません。受容体への濃度による作用や解離実験などのデータからは、エビリファイはドーパミン(-セロトニン)システム・スタビライザー(Dopamine-Serotonin System Stabilizer)であると、大塚製薬のMRは宣伝しています(下図。ハロペリドールは濃度が変わってもドーパミン受容体への作用は常に一定なのに対して、エビリファイは濃度に応じてドーパミン受容体への作用が変化する)。しかし、機能の面から、それが証明された訳ではありません。
いろんなタスクを被験者に試みてもらい、ドーパミンのレベルを上げた方がいいようなタスクと、逆に、ドーパミンのレベルを下げた方がいいタスクが、双方伴にエビリファイにて向上したという、ドーパミンレベルの柔軟性が保持されており、人の遂行機能からの証明がなければドーパミン(-セロトニン)システム・スタビライザーだとは言えないと思えます。

従って、製薬会社が言うような高用量が必ずしも必要という訳ではないようにも思えます。個々のケースで微調整をしていくべきでしょう(統合失調症でも3~6mg/日でも効果が十分に得られる場合がある)。セロトニン受容体に関しては、5-HT1Aに対してはアゴニストとして、5-HT2Aにアンタゴニストとして作用すると言われていますが、これがドーパミン受容体の時のように、用量などによってアゴニスト、アンタゴニストとして作用が変化するようです。こうなると、かなり複雑な薬だと言えます。予想とは逆に作用してしまうことがあり得るはずです。エビリファイでは使用量の微調整が重要なように思えます。使用用量によっては、必ずしも下の図のようにはならないと思えます。
一方、他のSGAよりも代謝障害(肥満や高血糖)を引き起すリスクが非常に低いということが、処方する側の医師に好まれているのかもしれません。確かに他のSGAよりは代謝障害のリスクは確実に低いと思えます。唯一の難点は他剤からエビリファイへとスイッチする際に失敗することがあることと、アカシジアが出やすいことですが、これを軽視しているドクターが時々おられます。特に、アカシジアは軽視すべきではありません。軽度ならばまだ我慢できるでしょうが、中等度以上のアカシジアは危険です。これほど辛い状態はなく、アカシジアの辛さに耐えられず死にたいと口走る患者さんがいる程です。
大塚製薬としては、本年度(2014年10月)中にアメリカでのパテント(特許)が切れてジェネリック攻撃に晒されるのが今から怖いようであり、今、このエビリファイの仲間の新薬の治験を日本でも行っています。なお、エビリファイのデポ剤が近々発売されることでしょう。デポ剤に切り替えてもらえば大塚製薬としてはまずは一安心かもしれません。
エビリファイのデポ剤の治験結果について。再発予防効果、PANSSスコアからみた病状の安定度など、かなり良い成績だったようです。下図。
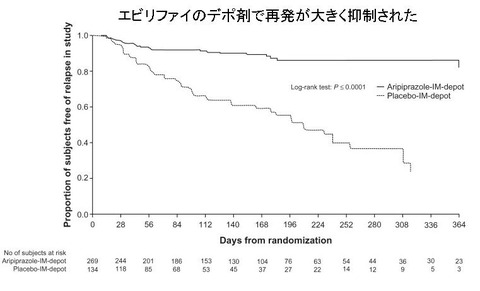
上の論文では、エビリファイのデポ剤の半減期は400 mgの用量では46.5日、300mgでは29.9日だったと述べられています。エビリファイのデポ剤では4週間に1回の注射で十分に維持していけることでしょう。6週間に1回の筋注でも維持できるかもしれません。元々、経口投与でも半減期が異常に長いので(なんと75時間)、その半減期の長さとドーパミンD2受容体への高親和性の特性からは、隔日投与も可能なはずであり、私は、他剤からエビリファイへスイッチする際には、置換が失敗しないように当初は2日に1回の上乗せ投与も試みたりしています。隔日投与でも同等の効果が得られるのであれば薬剤費の節約にもなります(隔日投与だと売り上げが半分になってしまうから、大塚製薬は絶対にこんな投与方法があるなんては言わないでしょうけども)。



コメント